Đặt vấn đề
Chitin là một polymer sinh học có trọng lượng phân tử cao, không tan trong nước, chứa các đơn phân là N-acetyl-glucosamine liên kết bởi β 1-4. Chitin phân bố rộng rãi trong tự nhiên, đóng vai trò là nguồn N và C cho nhiều loại vi sinh vật và bị thuỷ phân bởi enzyme chitinase.
Chitinase là enzyme thủy phân, có khối lượng phân tử dao động từ 20 kDa đến 90 kDa, chia làm hai nhóm chính endochitinases và exochitinase (Hamid & cs., 2013). Enzyme chitinase phân hủy chitin thành chitobiose hay chitotriose thông qua việc xúc tác phân giải liên kết 1,4 glucoside giữa C1 và C4 của hai phân tử N-acetyl glucosamine liên tiếp nhau trong chitin. Chitinase có tiềm năng ứng dụng trong nhiều lĩnh vực như: (i) nông nghiệp: kiểm soát nấm kí sinh gây bệnh trên cây trồng, sản xuất thuốc trừ sâu sinh học, thu nhận tế bào trần; (ii) y học: sản xuất glucosamine, N-acetyl glucosamine, chitooligosaccharides có khả năng kháng khuẩn, chống ung thư, chữa trị các bệnh thoái hóa khớp; (iii) môi trường: xử lý chất thải chứa chitin. (Mizuno & cs., 1997; Sashiwa & cs., 2002; Zarei & cs., 2010). Chitinase có khả năng phân huỷ chitin, thành phần chính cấu tạo nên thành tế bào nấm mốc, nên đã ức chế các loại nấm mốc gây hại trên cây trồng, như Rhizoctonia, Fusarium, Colletotrichum, Curvularia và Pythium.
Chitinase có thể thu được từ nhiều nguồn khác nhau như động vật, thực vật và vi sinh vật (vi khuẩn, nấm mốc, xạ khuẩn). Trong đó, enzyme chitinase từ vi sinh vật có nhiều ưu điểm như thời gian tổng hợp enzyme rất ngắn, có thế sử dụng nguyên liệu rẻ tiền. Một số loài vi khuẩn có khả năng sinh tổng hợp enzyme chitinase như Bacillus subtilis, Bacillus thuringiensis, Bacillus pumilus, Paenibacillus illinoisensis, Pseudomonas sp., Serratia marcescens (Hamid & cs., 2013; Jabeen & Qazi, 2014)
Vi sinh vật được tìm thấy nhiều ở trong môi trường tự nhiên như đất, nước. Đất là nơi cư trú rộng rãi của vi sinh vật do trong đất có một lượng lớn các chất hữu cơ làm nguồn thức ăn cho các nhóm vi sinh vật dị dưỡng. Vùng rễ cây là nơi vi sinh vật phát triển mạnh nhất vì dịch tiết từ rễ cây chứa nhiều chất hữu cơ có tác dụng như nguồn dinh dưỡng cho vi sinh vật. Ngoài ra, rễ cây còn làm đất thoáng khí và giữ được độ ẩm. Vi khuẩn chiếm đa số trong tổng số vi sinh vật vùng rễ bao gồm vi khuẩn, nấm, xạ khuẩn, động vật nguyên sinh và tảo. Nhiều chủng vi khuẩn đất vùng rễ có khả năng kích thích sinh trưởng thực vật và sinh enzyme chitinase được sử dụng như tác nhân kiểm soát sinh học nấm bệnh (Nguyễn Thị Pha & cs., 2014). Do đó, các chủng vi khuẩn phân lập từ đất vùng rễ cây trồng có khả năng sinh enzyme có hoạt tính cao ngày càng được quan tâm, tạo điều kiện cho việc nghiên cứu, sản xuất các chế phẩm chitinase và ứng dụng chúng trong đời sống.
Kết quả
Phân lập các chủng vi khuẩn từ đất vùng rễ cây trồng
Từ các mẫu đất ở vùng rễ cây cà chua và chuối thu thập được ở Hà Nội, Hưng Yên và Thái Bình đã phân lập được 55 chủng vi khuẩn. Đặc điểm hình thái khuẩn lạc, tế bào của một số chủng được trình bày tại Hình 1 và Hình 2.
    |
 |
| Hình 1. Đặc điểm khuẩn lạc của một số chủng vi khuẩn phân lập từ đất vùng rễ cây trồng |
Khuẩn lạc của các chủng vi khuẩn đa số có màu trắng, màu kem, chủng GLV03 có màu vàng. Bề mặt khuẩn lạc nhăn, khô, bằng phẳng, mép chia thùy hoặc mép nguyên. Các chủng là trực khuẩn Gram dương, đứng riêng lẻ hoặc thành chuỗi ngắn.
    |
 |
| Hình 2. Hình thái tế bào của một số chủng vi khuẩn phân lập từ đất vùng rễ cây trồng |
Xác định khả năng sinh enzyme chitinase của các chủng vi khuẩn phân lập từ đất vùng rễ cây trồng
Các chủng vi khuẩn phân lập từ đất vùng rễ cây trồng được xác định khả năng phân giải chitin bằng phương pháp khuếch tán trên đĩa thạch (Nguyễn Thị Hà, 2012). Kết quả được thể hiện ở Bảng 1 và Hình 3.
Bảng 1. Khả năng sinh enzyme chitinase của một số chủng vi khuẩn phân lập từ đất vùng rễ cây trồng
|
STT
|
Tên chủng
|
Vòng phân giải chitin (mm)
|
STT
|
Tên chủng
|
Vòng phân giải chitin (mm)
|
|
1
|
TB02
|
24,67 ± 0,58
|
12
|
KC03
|
22,00 ± 0,50
|
|
2
|
TB07
|
16,17 ± 0,29
|
13
|
KC13
|
18,67 ± 0,58
|
|
3
|
TB10
|
19,50 ± 0,70
|
14
|
KC14
|
19,17 ± 0,29
|
|
4
|
TB12
|
26,50 ± 0,50
|
15
|
KC18
|
19,33 ± 0,58
|
|
5
|
HY3
|
16,00 ± 0,58
|
16
|
VG01
|
19,17 ± 0,29
|
|
6
|
HY7
|
17,83 ± 0,16
|
17
|
VG04
|
17,83 ± 0,76
|
|
7
|
QP01
|
18,67 ± 0,58
|
18
|
VG11
|
21,17 ± 0,29
|
|
8
|
QP06
|
16,50 ± 0,50
|
19
|
HN02
|
20,33 ± 0,58
|
|
9
|
QP07
|
20,33 ± 0,58
|
20
|
GL03
|
20,67 ± 0,58
|
|
10
|
QP14
|
18,67 ± 0,58
|
21
|
GL14
|
20,33 ± 0,58
|
|
11
|
QP16
|
20,50 ± 0,58
|
22
|
GL19
|
18,67 ± 0,58
|
Kết quả khảo sát khả năng sinh enzyme chitinase từ các chủng vi khuẩn phân lập từ đất vùng rễ cây trồng cho thấy tỷ lệ chủng vi khuẩn sinh enzyme chitinase chiếm hơn 30%. Trong đó, các chủng có khả năng phân giải chitin yếu và trung bình chiếm tỷ lệ cao. Một số chủng vi khuẩn có đường kính vòng phân giải chitin lớn hơn 20mm như TB02, TB12, QP07, QP16, KC03, VG11, HN02, GL03 và GL14. Chủng TB12 phân lập từ đất vùng rễ cây chuối có khả năng phân giải chitin mạnh nhất, với đường kính vòng phân giải 26,5mm.
    |
 |
| Hình 3. Vòng phân giải chitin của một số chủng vi khuẩn phân lập từ đất vùng rễ cây trồng |
Xác định hoạt độ enzyme chitinase của một số chủng vi khuẩn có khả năng phân hủy chitin mạnh
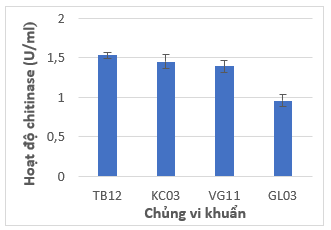
Bốn chủng KC03, TB12, VG11 và GL03 có khả năng phân hủy cơ chất chitin cao được xác định hoạt độ enzyme chitinase theo phương pháp so màu với thuốc thử DNS (3,5-dinitrosalicylic acid) (Nguyễn Thị Hà, 2012).
    |
 |
| Hình 4. Hoạt độ enzyme chitinase của một số chủng vi khuẩn có khả năng phân hủy chitin mạnh |
Từ Hình 4 cho thấy hai chủng vi khuẩn TB12 và KC03 phân lập từ đất vùng rễ cây chuối và cà chua có hoạt độ enzyme cao nhất lần lượt là 1,53 và 1,45 U/ml. Hoạt độ enzyme chitinase của hai chủng này cao hơn so với hoạt độ chitinase của chủng vi khuẩn Bacillus licheniformis MS3 được phân lập từ đất vùng rễ (1,27 U/ml) (Kamil & cs., 2007).
Kết luận
Từ các mẫu đất vùng rễ cây cà chua và chuối đã phân lập được 9 chủng vi khuẩn có khả năng sinh enzyme chitinase cao. Trong đó, chủng TB12 có khả năng phân giải chitin mạnh nhất với hoạt độ enzyme chitinase là 1,53 U/ml. Chủng này có triển vọng ứng dụng để sản xuất các chế phẩm sinh học để kiểm soát nấm gây bệnh thực vật trong nông nghiệp và xử lý chất thải chứa chitin làm giảm ô nhiễm môi trường.
Th.S. Trần Thị Hồng Hạnh, NCS Khoa CNSH