Lignin là một polyme thơm alkyl được tìm thấy trong thành tế bào của thực vật trên cạn. Lignin cung cấp cấu trúc và độ cứng cho thực vật, là hàng rào tự nhiên, hiệu quả cao chống lại sự tấn công của vi sinh vật, đồng thời cho phép vận chuyển nước và chất dinh dưỡng qua các mô thực vật. Tùy thuộc vào loài thực vật, các thành phần của lignin có thể khác nhau đáng kể, dẫn đến sự đa dạng đáng kể về cấu trúc và hóa học lignin.
Ba khối cấu tạo cơ bản của lignin, p- coumaryl alcohol, coniferyl alcohol và sinapyl alcohol, được tổng hợp thông qua con đường phenylpropanoid ở thực vật và khác nhau về mức độ metoxyl hóa của chúng (tương ứng 0, 1 và 2). Lignin được tổng hợp thông qua quá trình khử hydro bằng enzyme của các monome này, chúng tạo thành cả liên kết C – O và C – C, dẫn đến cấu trúc không đồng nhất và cấu trúc ba chiều.
Hàm lượng lignin trong thực vật được đo bằng phương pháp Klason, là 25–35% trong gỗ mềm, 20–25% trong gỗ cứng, và 15–25% trong cây thân thảo [1]. Trong thành tế bào của một loại gỗ cứng, sự lắng đọng lignin bắt đầu từ phiến giữa, sau đó ở vách sơ cấp và lớp S1 ở vách thứ cấp. Sau đó, lignin nằm ở lớp S2 và S3. Ngoài ra, lignin hoạt động như một chất liên kết lâu dài giữa các tế bào, dự trữ năng lượng, chất chống oxy hóa, chất ngăn chặn tia cực tím và chất kỵ nước ở thực vật.
Trong tự nhiên, có các sinh vật khác nhau phân hủy lignin; tuy nhiên, hiệu quả nhất là nấm thuộc nhóm nấm mục trắng [2]. Những vi sinh vật này sở hữu một hệ thống enzyme để phân hủy lignin một cách hiệu quả (Lignolytic). Hệ thống này chứa ba enzyme chính laccase, mangan peroxidase (MnP) và lignin peroxidase. Trong sản xuất nhiên liệu sinh học, các enzyme ligninolytic có hai mục đích chính, khử trùng và khử độc. Phương pháp khử trùng áp dụng nấm ligninlytic và các enzyme của chúng để làm giảm hàm lượng lignin trong một số nguyên liệu thô [3].
Laccase
Laccase (EC 1.10.3.2) còn được gọi là benzenediol: oxy oxidoreductase hoặc p-diphenol oxidase thuộc lớp oxidoreductase. Laccase phân bố rộng rãi ở vi sinh vật, côn trùng và thực vật, thể hiện một chức năng cụ thể ở mỗi loài. Từ nhóm này, nấm thối trắng là loại nấm được nghiên cứu nhiều nhất. Những loại nấm này sử dụng các enzym của chúng để phá vỡ thành lignocellulosic của cây và lấy chất dinh dưỡng của vật chủ. Các enzyme nấm này làm suy giảm cấu trúc polyphenol phức tạp tạo thành lignin, thành phần chính có tính kiềm chế trong thành lignocellulosic [4].
Laccase có nhiều ở vi sinh vật, côn trùng và thực vật, thể hiện chức năng cụ thể ở mỗi loài. Laccase có tính đặc hiệu cơ chất thấp. Đặc tính này cho phép phân hủy một số hợp chất có cấu trúc phenolic. Do đó, laccase đã được ứng dụng trong một số lĩnh vực như xử lý sinh học các hợp chất có mùi thơm, xử lý nước thải ô nhiễm lignin, tổng hợp các chất hóa học, phân hủy một số lượng lớn thuốc nhuộm trong ngành dệt, và tiền xử lý sinh khối để sản xuất nhiên liệu sinh học.
Một loài sinh vật có thể sinh tổng hợp có nhiều loại laccase khác nhau (các isozyme) và các isozyme thường khác nhau về trình tự axit amin và tính chất động học xúc tác. Isozyme laccase khác nhau ở mức độ glycosyl hóa và thành phần các gốc carbonhydrat. Phân tử laccase có khối lượng phân tử dao động trong khoảng 60-100 kDa. Phần lớn laccase của nấm có bản chất là glycoprotein với hàm lượng carbonhydrate chiếm khoảng 10-25%. Tuy vậy, tất cả laccase đều giống nhau về cấu trúc trung tâm xúc tác với 4 nguyên tử đồng.
    |
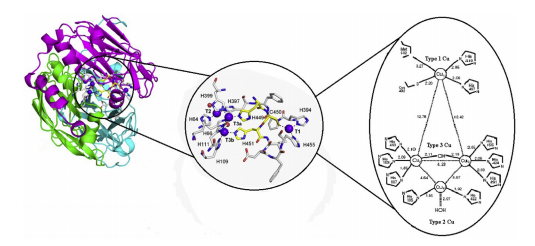 |
| Hình 1. Cấu trúc phân tử và vị trí hoạt động của Laccase [5] |
Lignin peroxidase (EC 1.11.1.14) là một loại enzyme có khả năng oxy hóa các hợp chất lignin và các dẫn xuất của lignin. Lignin peroxidase có thể thu từ các nguồn khác nhau như nấm mốc, thực vật, vi khuẩn, côn trùng nhưng phổ biến nhất là nấm mục trắng. Hiện nay nhiều chủng nấm mục được phát hiện cho thấy có khả năng tổng hợp lignin peroxidase rất tốt như: Phanerochaete chrysosporium, Trametes versicolor, Phlebia radiate.
    |
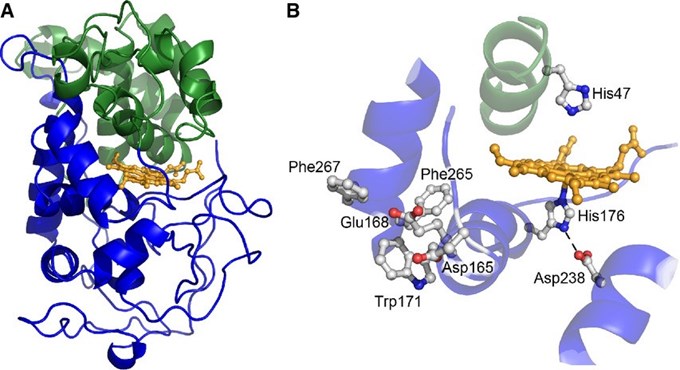 |
| Hình 2. Cấu trúc tinh thể của P. chrysosporium LiP [6] |
Ưu điểm của LiP là khả năng oxy hóa cao và pH tối ưu thấp, do đó có thể nghiên cứu để đưa vào ứng dụng rộng rãi trong nhiều ngành khác nhau. Lignin peroxidase có thể ứng dụng trong công nghiệp tẩy trắng giấy, tẩy màu của thuốc nhuộm vải [7] và loại bỏ hợp chất phenol trong rượu. Lignin peroxidase còn được sử dụng trong xử lý nguồn nước thải bị ô nhiễm bằng việc loại bỏ các hợp chất phenol, và xử lý COD/BOD cao có trong chất thải giàu phenol. Ngoài ra, LiP còn ứng dụng trong nông nghiệp như xử lý và phân tích nhanh dư lượng các loại thuốc trừ sâu, thuốc diệt cỏ có họ phenol ứng dụng trong xử lý phụ phẩm nông nghiệp như rơm, rạ, bã mía để tạo nguyên liệu cho các quá trính khác.
Họ LiP có chứa nhiều isozyme, các isozyme khác nhau đối với từng chủng nấm về điều kiện nuôi cấy, khối lượng phân tử, điểm đẳng điện... LiP có thể oxy hoá các hợp chất lignin và liên quan đến lignin, như là phân cắt liên kết Carbon α – Carbon β, liên kết aryl - carbon α, mở vòng thơm và dimethoxyl hoá. LiP còn có tiềm năng làm giảm thiểu ô nhiễm môi trường như giảm poly-clo biphenyl, poly- hydrocarbon thơm.
Lignin peroxidase trong môi trường ngoại bào của nấm thối trắng; P. chrysosporium [8], các isozyme khác nhau đã được xác định trong các sinh vật sau: P. chrysosporium [9], Tramates versicolor [10], Phlebia radiata [11].
Mangan peroxidase
Mangan peroxidase (EC 1.11.1.13 ) là một protein heme được glycosyl hóa với khối lượng phân tử ~ 40–50 kDa; nó đại diện cho peroxidase biến đổi lignin phổ biến nhất được sản xuất và tiết ra bởi hầu hết tất cả các loài basidiomycetes sống trên gỗ, bao gồm bệnh thối trắng và các loại nấm sống trong đất khác nhau. Hoạt động của enzyme này đã được phát hiện ở P. chrysosporium gần 30 năm trước: glycoprotein có tính axit 46-kDa (pI 4.5) đã được chứng minh để khử trùng và trùng hợp các phân tử lignin tổng hợp được tạo ra bắt đầu từ coniferyl hoặc rượu sinapyl khi có mặt 0,2 m m Mn 2+, ở pH 4,5 và ở 37°C.
Thật vậy, MnP là heme peroxidase duy nhất thể hiện cơ chế phản ứng oxy hóa Mn 2+ một điện tử. Mn 3+ phân ly khỏi enzyme và được tạo phức bởi các axit cacboxylic, đặc biệt là oxalat và malat: Phức hợp Mn 3+ hoạt động như một chất oxy hóa khuếch tán của các hợp chất phenolic, tạo ra chất trung gian gốc phenoxy tạo ra các sản phẩm phân hủy khác nhau. Dạng Mn3+ oxy hóa các hợp chất phenolic (chẳng hạn như 2,6-dimethoxyphenol, guaiacol, 4-metoxyphenol và các gốc lignin phenolic), trong khi nó không hoạt động trên chất nền VA hoặc phiphenolic [12].
    |
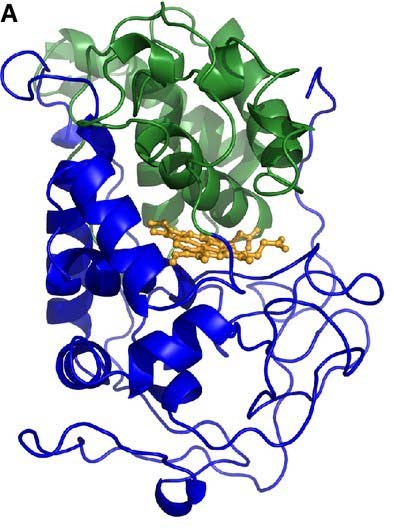 |
| Hình 3. Biểu diễn giản đồ cấu trúc 3D của MnP từ P. chrysosporium [13] |
TÀI LIỆU THAM KHẢO
[1] C. W. Dence (1992), "The determination of lignin", Methods in lignin chemistry, Springer, pp. 33-61.
[2] Caixia Wan and Yebo Li (2011), "Effectiveness of microbial pretreatment by Ceriporiopsis subvermispora on different biomass feedstocks", Bioresource technology, 102(16), pp. 7507-7512.
[3] D. Salvachúa, A. Prieto, M. López-Abelairas, T. Lu-Chau, Á. T. Martínez, and M. J. Martínez (2011), "Fungal pretreatment: an alternative in second-generation ethanol from wheat straw", Bioresource technology, 102(16), pp. 7500-7506.
[4] K.N. Niladevi (2009), "Ligninolytic enzymes", pp. 393-414.
[5] A. Kumar and R. Chandra (2020), "Ligninolytic enzymes and its mechanisms for degradation of lignocellulosic waste in environment", Heliyon, 6(2), p. e03170.
[6] Ram Chandra, Vineet Kumar, and Sheelu Yadaw (2017), "Extremophylic ligninolytic enzyme", Chapter 8, p. 131.
[7] A. D. Bholay, B. V. Borkhataria, P. U. Jadhav, K. S. Palekar, M. V. Dhalkari, and P. M. Nalawade (2012), "Bacterial Lignin Peroxidase: A Tool for Biobleaching and Biodegradation of Industrial Effluents", Universal Journal of Environmental Research & Technology, 2(1).
[8] Ming Tien and T Kent Kirk (1983), "Lignin-degrading enzyme from the hymenomycete Phanerochaete chrysosporium Burds", Science, 221(4611), pp. 661-663.
[9] Roberta L Farrell, Karen E Murtagh, Ming Tien, and Cs (1989), "Physical and enzymatic properties of lignin peroxidase isoenzymes from Phanerochaete chrysosporium", Enzyme and microbial technology, 11(6), pp. 322-328.
[10] Tomas Johansson, Karen G Welinder, and Per Olof Nyman (1993), "Isozymes of lignin peroxidase and manganese (II) peroxidase from the white-rot basidiomycete Trametes versicolor: II. Partial sequences, peptide maps, and amino acid and carbohydrate compositions", Archives of Biochemistry and Biophysics, 300(1), pp. 57-62.
[11] A. Moilanen, T. Lundell, T. Vares, and A. Hatakka (1996), "Manganese and malonate are individual regulators for the production of lignin and manganese peroxidase isozymes and in the degradation of lignin by Phlebia radiata", Applied microbiology and biotechnology, 45(6), pp. 792-799.
[12] C. Sánchez (2009), "Lignocellulosic residues: biodegradation and bioconversion by fungi", Biotechnology advances, 27(2), pp. 185-194.
[13] Loredano Polleygion, Fabio Tonin, and Elena Rosini (2015), "Lignin- degrading enzymes", The FEBS 282(7), pp. 1190-1213.
Trịnh Thị Thu Thủy - Khoa Công nghệ sinh học